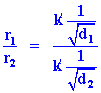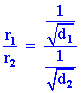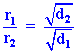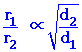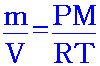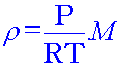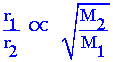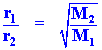![]()
โทมัส แกรห์ม (Thomas Graham) ค.ศ.1805 -1869)
การแพร่ (diffusion) ของสารต่างๆ หมายถึง อนุภาคของสารนั้นเคลื่อนที่ไปจากบริเวณที่มีความเข้มข้นสูงไปยังบริเวณความเข้มข้นต่ำกว่า ในกรณีของแก๊ส ก็หมายถึง การที่โมเลกุลของแก๊สชนิดหนึ่งเคลื่อนที่กระจายออกไปจากบริเวณที่มีความหนาแน่นมากไปหาบริเวณที่มีความหนาแน่นน้อยกว่าและหลังจากนั้นแก๊สก็จะกระจายตัวให้มีความเข้มข้นโดยเฉลี่ยทุกบริเวณเท่าๆกัน การแพร่ก็จะสามารถเกิดขึ้นได้ต่อเนื่องจนระดับความเข้มข้นของแก๊สทุกบริเวณที่แก๊สไหลไปได้นั้นมีค่าเท่ากัน แก๊สจึงจะหยุดแพร่ แต่แก๊สก็มีการเคลื่อนที่ตลอดเวลา โดยแก๊สที่ผสมกันต้องไม่เกิดปฏิกิริยาเคมีกัน ดังนั้น การแพร่ของแก๊สนี้จึงเป็นการเปลี่ยนแปลงทางกายภาพอย่างเดียว ไม่มีปฏิกิริยาเคมีเกิดขึ้น
ถึงแม้ว่าโมเลกุลของแก๊สจะเคลื่อนที่ด้วยความเร็วสูงมาก แต่ก็เป็นการเคลื่อนที่แบบสุ่ม ดังรูปข้างล่าง กว่าจะถึงจุดหมายปลายทาง ถ้าดูแต่ละอะตอม หรือโมเลกุลของแก๊ส จะพบว่าระหว่างทางต้องเจออุปสรรคมากมายจากการชนกับโมเลกุลแก๊สชนิดเดียวกันหรือแก๊สชนิดอื่น รวมทั้งเกิดการชนผนังภาชนะอีกด้วย ทำให้กว่าจะไปถึงที่หมายต้องเสียเวลาไปชนตัวนั้น เฉียดตัวนี้ เสมอๆ ดังรูป
แสดงเส้นทางเดินของอนุภาคแก๊สชนิดหนึ่ง จาก A ไป B
เราจะมาดูว่าในวิถีการเดินทางของแก๊สสีแดง จากจุด A ไปจุด B นั้น แก๊สสีแดงจะใช้เวลาเดินทางเท่าไหร่
คำว่าอัตราการแพร่ (r) ก็คือดูแก๊สเดินทางจาก จุด A ไป B ด้วยอัตราเร็วเท่าไหร่ในหนึ่งหน่วยเวลา เช่นเดียวกับการถามว่า รถเมล์สายนี้วิ่งเร็วเท่าไหร่ แต่ในกรณีของแก๊สระหว่างทางจะเกิดการชนกับโมเลกุลอื่นๆไปด้วย พร้อมกับเคลื่อนที่ไปพร้อมกับการชนกับโมเลกุลอื่นพร้อมๆ กันลักษณะนี้จึงเรียกว่าการแพร่ (diffusion)
การไหลเข้ามาผสมกันของแก๊สสองชนิดมีพฤติกรรมเป็นอย่างไร มีปัจจัยใดบ้างที่ต้องพิจารณากัน
เราอยากทราบพฤติกรรมการแพร่ของแก๊สชนิดต่างๆ ว่าจะเหมือนหรือแตกต่างกันอย่างไร มาพิจารณารูปด้านล่าง
รูปด้านล่างแสดงการแพร่เข้าหากันของแก๊สสองชนิด แก๊สชนิดสีแดงกับแก๊สสีน้ำเงิน สมมติให้แก๊สสีแดงมีมวลมากกว่าแก๊สสีน้ำเงิน แก๊สสองชนิดนี้มีอัตราการแพร่ที่แตกต่างกัน อัตราการไหลของแก๊สทั้งสองชนิดที่แตกต่างกันนี้เป็นเพราะอะไร
เมื่อปี ค.ศ. 1832 นักเคมีชาวสก๊อต ชื่อว่า ทอมัส แกรห์ม ได้ทำการศึกษาแก๊ส และพบว่า ภายใต้สภาวะอุณหภูมิและความดันเดียวกัน อัตราการแพร่ของแก๊สจะเป็นสัดส่วนผกผันกับรากที่สองของมวลแก๊สนั้นต่อโมล
นั่นหมายความว่า แก๊สที่มีน้ำหนักมากกว่าจะเคลื่อนไหวได้ช้ากว่าแก๊สที่เบากว่า เหมือนแก๊สสีแดงจากรูปด้านบนมีขนาดใหญ่มีน้ำหนักมากจะเคลื่อนที่ผ่านรูได้ช้ากว่าแก๊สสีน้ำเงินซึ่งมีน้ำหนักน้อยกว่า
เนื่องจากมวลมีความสัมพันธ์กับความหนาแน่นโดยตรง ถ้ากำหนดให้แก๊สสองชนิดมีปริมาตรเท่ากัน จะพบว่าแก๊สที่มีมวลมากกว่าจะมีความหนาแน่นมากกว่าแก๊สที่มีมวลน้อย ดังนั้นเราจึงแสดงได้ในเทอมของความหนาแน่นได้ อัตราการแพร่ของแก๊สเป็นสัดส่วนผกผันกับรากที่สองของความหนาแน่นของแก๊สนั้นเช่นเดียวกับมวลหรือมวลโมเลกุล
อัตราการแพร่
=
|
เมื่อ
|
กำหนดให้
| r1= อัตราเร็วของแก๊สชนิดที่หนึ่ง r2 = อัตราเร็วของแก๊สชนิดที่สอง d1 = ความหนาแน่นของแก๊สชนิดที่หนึ่ง d2 = ความหนาแน่นของแก๊สชนิดที่สอง k = ค่าคงที่ของการแพร่ |
จะได้ว่า
จะได้ว่า
จะได้
เอาสมการ (1) หาร (2)
เนื่องจากความหนาแน่นเป็นสัดส่วนโดยตรงกับมวลโมเลกุลที่ P และ T คงที่ จาก
จะเห็นได้ว่า
ความหนาแน่น ( ดังนั้น จาก
|
พฤติกรรมของแก๊สลักษณะนี้ สามารถนำไปใช้หาอัตราการแพร่ของแก๊ส 2 ชนิดที่มีมวลแตกต่างกันได้ แม้แต่มวลที่ต่างกันน้อยมาก เช่น นำไปใช้แยกไอโซโทปของยูเรเนียมในสารประกอบยูเรเนียมเฮกซะฟลูออไรด์ (UF6) ของ U-235 ออกจาก U-238 โดยการใช้หลักการแพร่นี้
รูปแสดงการแพร่ผ่านของแก๊สในภาชนะ
การแพร่ผ่าน (effusion) คือปรากฏการณ์ที่แก๊สเคลื่อนที่จากบริเวณหนึ่งที่มีความเข้มข้นของแก๊สสูงกว่า ผ่านรูเล็กๆ ไปยังบริเวณที่มีแก๊ส มีความเข้มข้นน้อยกว่าหรือยังไม่มีแก๊สชนิดนั้นอยู่
การแพร่ในลักษณะนี้จึงเรียกว่าการแพร่ผ่าน ซึ่งก็คือปรากฏการณ์ที่แก๊สเคลื่อนจากบริเวณหนึ่งผ่านรูเล็กๆ ไปยังบริเวณแก๊สที่มีความเข้มข้นน้อยกว่าหรือบริเวณที่ไม่มีแก๊สชนิดนั้นอยู่ โดยขณะที่แก๊สแพร่ผ่านไปจะเกิดการชนกันระหว่างโมเลกุลหรือชนผนังภาชนะไปด้วย
ส่วนรูปด้านบนนี้เป็น การสาธิต การแพร่ผ่าน จากรูปโมเลกุลแก๊สสีแดงแพร่จากกล่องด้านซ้ายมือแพร่ผ่านรูเล็กๆ ไปยังบริเวณกล่องที่เป็นสูญญากาศด้านขวามือ