| |
4. แผนผังวัฏภาค (phase diagram)
เป็นที่ทราบกันดีแล้วว่า
สสาร มี 3 สถานะ คือ ของแข็ง ของเหลว และแก๊ส และในแต่ละสถานะสามารถเปลี่ยนแปลงไปมาระหว่างกันได้เมื่ออยู่ในสภาวะที่เหมาะสม
เราสามารถเขียนแผนผังการเปลี่ยนแปลงของสารที่อยู่ในสถานะของแข็ง ของเหลว
และแก๊ส ที่อุณหภูมิและความดันต่าง ๆ ไว้ในแผนผังเดียวกันได้ และเรียกแผนผังนี้ว่า
แผนผังวัฏภาค (phase diagram) ดังรูป
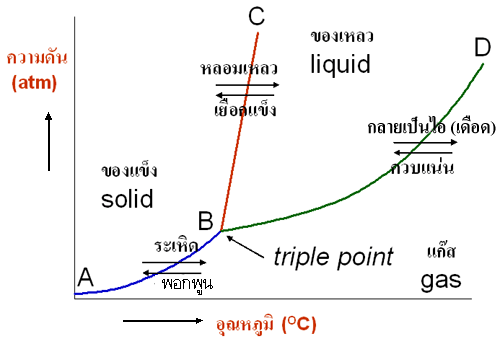
จากรูป แผนผังแบ่งออกได้เป็น 3 ส่วน แต่ละส่วนจะมีอยู่เพียงวัฏภาค (phase) เดียว คือ ของแข็ง ของเหลว หรือแก๊ส เส้น AB เป็นเส้นสมดุลวัฏภาคระหว่างของแข็งกับแก๊ส และเป็นเส้นแบ่งส่วนที่เป็นของแข็งกับแก๊ส เส้น BC เป็นเส้นสมดุลวัฎภาคระหว่างของแข็งกับของเหลว และเป็นเส้นแบ่งส่วนที่เป็นของแข็งกับของเหลว โดยทั่วไปแล้ว แนวโน้มของเส้น BC ส่วนใหญ่จะเบนไปทางขวามือ (ดังกราฟ) ยกเว้น น้ำ เพราะว่าน้ำที่เป็นของแข็งจะมีปริมาตรมากกว่าน้ำที่เป็นของเหลว จึงทำให้ความหนาแน่นของน้ำที่เป็นของแข็งจะมีค่าน้อยกว่าความหนาแน่นของน้ำที่เป็นของเหลว และเส้น BD เป็นเส้นสมดุลวัฏภาคระหว่างของเหลวกับแก๊ส และเป็นเส้นแบ่งส่วนที่เป็นของเหลวกับแก๊ส
จุดที่เส้นสมดุลทั้ง 3 เส้นมาตัดกันที่จุด B ซึ่งเป็นจุดที่แสดงถึง อุณหภูมิและความดันที่ทำให้ ของแข็ง ของเหลว และแก๊ส อยู่ร่วมในภาวะสมดุลกันที่จุดเดียวกัน เรียกว่า จุดร่วมสาม (triple point)
จุด D เรียกว่า จุดวิกฤต (critical point) เป็นจุดสุดท้ายที่สามารถแบ่งและเห็นขอบเขตสมดุลระหว่างของเหลวกับแก๊สได้ เมื่อเราพิจารณาจุดที่อยู่เหนือขอบเขตจุดนี้ขึ้นไป สสารจะมีพฤติกรรมแตกต่างไปจากของเหลวและแก๊ส กล่าวง่ายๆ คือ เราจะไม่สามารถพิจารณา และแบ่งแยกระหว่างของเหลวและแก๊สได้เลย
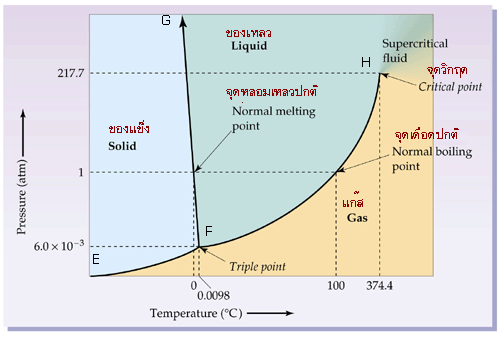
จากกราฟแผนผังวัฏภาคของน้ำ ที่ความดัน 1บรรยากาศ เราสามารถพิจารณาสิ่งที่เกิดขึ้นได้ดังต่อไปนี้
จุดหลอมเหลว (melting point) คือ จุดที่ทำให้น้ำเปลี่ยนจากสถานะของแข็งกลายเป็นของเหลวที่อุณหภูมิ 0 องศาเซลเซียส เราสามารถเปลี่ยนน้ำจากสถานะของแข็งเป็นแก๊ส โดยไม่ผ่านสถานะของเหลว (จากพื้นที่ส่วนที่เป็นสีฟ้าไปสีเหลืองโดยไม่ผ่านสีเขียว) ได้จนความดันต่ำกว่า 6 x 10-3 บรรยากาศ
จุดเดือด (boiling point) คือ จุดที่ทำให้น้ำเปลี่ยนจากสถานะของเหลวกลายเป็นแก๊ส ที่จุดเดือดปกติ (ความดัน 1 บรรยากาศ) น้ำมีจุดเดือดที่ 100 องศาเซลเซียส
จุดร่วมสาม (triple point) ของน้ำ จะอยู่ที่ความดัน 6 x 10-3 บรรยากาศ อุณหภูมิ 0.0098 องศาเซลเซียส
จุดวิกฤต (critical point) ของน้ำ จะอยู่ที่ความดัน 217.7 บรรยากาศ อุณหภูมิ 374.4 องศาเซลเซียส
คำถามชวนให้คิด
1. จากการเปลี่ยนแปลงสถานะของน้ำ เราทราบกันดีแล้วว่า ปกติที่ความดัน 1 บรรยากาศ จุดหลอมเหลว และจุดเดือดของน้ำ จะพบที่อุณหภูมิเท่ากับ 0 และ 100 องศาเซลเซียส ซึ่งเรียกว่าจุดหลอมเหลว และจุดเดือดปกติ ตามลำดับ แต่ในความเป็นจริงแล้ว จุดหลอมเหลว และจุดเดือดของน้ำมีมากกว่า 1 จุด จากแผนผังวัฏภาคของน้ำ นักเรียนสามารถระบุจุดต่างๆ ที่เราสามารถพบจุดหลอมเหลว และจุดเดือดของน้ำได้อีกหรือไม่?
2. จากรูปต่อไปนี้
หมู่บ้านแห่งหนึ่ง ที่อยู่ในที่ราบ ระดับน้ำทะเล |
เทือกเขาหิมาลัย |
แม่บ้านคนหนึ่ง ที่อาศัยอยู่ในหมู่บ้านที่ตั้งอยู่ในที่ราบระดับน้ำทะเล ได้ต้มไข่เพื่อทำกับข้าวให้สมาชิกในครอบครัว ทุกๆ ครั้งที่ต้มไข่ พบว่า น้ำในหม้อจะเดือดที่อุณหภูมิ 100 องศาเซลเซียสเสมอ ถ้าแม่บ้านคนนี้นำไข่ไปต้มที่ยอดเขาเอเวเรส ของเทือกเขาหิมาลัย น้ำในหม้อจะเดือดที่อุณหภูมิสูงกว่าหรือต่ำกว่า 100 องศาเซลเซียส?
ตารางต่อไปนี้ แสดงค่าอุณภูมิวิกฤติ (critical temperature; Tc ) และความดันวิกฤติ (critical pressure; Pc ) ของสารต่างๆ ที่สำคัญ
สาร |
Tc
(OC) |
Pc
(atm) |
| แอมโมเนีย (NH3) | 132.4 |
111.5 |
| อาร์กอน (Ar) | -186 |
6.3 |
| เบนซีน (C6H6) | 288.9 |
47.9 |
| คาร์บอนไอออกไซด์ (CO2) | 31.1 |
73 |
| เอทานอล (CH3CH2OH) | 243 |
63 |
| ไดเอทิลอีเทอร์ (CH3CH2OCH2CH3) | 192.6 |
35.6 |
| ปรอท (Hg) | 1462 |
1036 |
| มีเทน (CH4) | -83 |
45.6 |
| ไฮโดรเจน (H2) | -239.9 |
12.8 |
| ไนโตรเจน (N2) | -147.1 |
33.5 |
| ออกซิเจน (O2) | -118.8 |
49.7 |
| ซัลเฟอร์เฮกซะฟลูออไรด์ (SF6) | 45.5 |
37.6 |
| น้ำ (H2O) | 374.4 |
217.7 |
คำถามชวนให้คิด
สมมติว่า เรานำเครื่องดื่มน้ำอัดลมชนิดกระป๋อง เช่น coke หรือ pepsi เป็นต้น ซึ่งยังไม่ได้เปิดฝาแต่อย่างใด แล้วนำไปแช่ในตู้เย็นที่มีอุณหภูมิเท่ากับ -5 OC โดยแช่กระป๋องให้มีอุณหภูมิเท่ากับอุณหภูมิดังกล่าว หลังจากนั้นนำกระป๋องมาเปิดฝา โดยเปิดฝาออกอย่างรวดเร็ว ลองทำนายซิว่า ผลที่เกิดขึ้นจะเป็นอย่างไร?
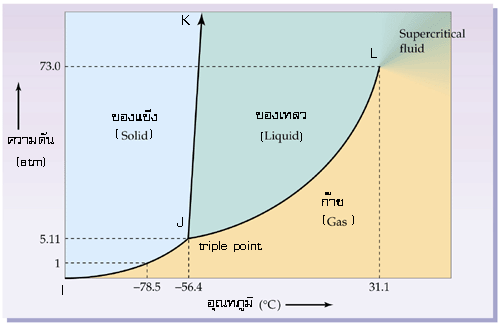
กราฟแสดงแผนผังวัฏภาคของคาร์บอนไดออกไซด์ (phase diagram of carbondioxide : CO2)
จากกราฟ จะเห็นได้ว่า ที่ความดัน 1บรรยากาศ (atm) อุณหภูมิที่จะทำให้เราสามารถเห็นการเปลี่ยนแปลงสถานะของคาร์บอนไดออกไซด์ระหว่างของแข็งกับของแก๊สได้นั้น ก็คือที่ -78.5 OC จากกราฟ อุณหภูมิห้อง (25 OC) คาร์บอนไดออกไซด์จะมีสถานะเป็นแก๊ส ดังนั้น จึงไม่เป็นเรื่องแปลกเลยที่ในชีวิตประจำวัน เราจะพบคาร์บอนไดออกไซด์ในสถานะแก๊สเท่านั้น
จุดร่วมสาม ของคาร์บอนไดออกไซด์ จะพบได้ที่ความดัน 5.11 บรรยากาศ อุณหภูมิ -56.4 องศาเซลเซียส
จุดวิกฤต ของคาร์บอนไดออกไซด์ จะอยู่ที่ความดัน 73.0 บรรยากาศ อุณหภูมิ 31.1 องศาเซลเซียส
ในอุตสาหกรรมการทำน้ำแข็งแห้ง หรือการทำคาร์บอนไดออกไซด์ที่เป็นของแข็ง
สามารถทำโดยการเปลี่ยนคาร์บอนไดออกไซด์จากสถานะแก๊ส (อุณหภูมิห้อง 25 oC)
ไปเป็นของแข็ง สามารถทำได้โดยใช้ประโยชน์จากแผนผังวัฏภาคของคาร์บอนไดออกไซด์
เก็บตกความรู้
คาร์บอนไดออกไซด์ซึ่งมีสูตรโมเลกุล เป็น CO2
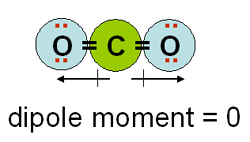
จากผลรวมของค่า dipole moment ซึ่งมีค่าเท่ากับ 0 ดังนั้น คาร์บอนไดออกไซด์จึงเป็นสารที่ไม่มีขั้ว ในอุตสาหกรรมการสกัดสารคาเฟอีน (caffeine) จากกาแฟ
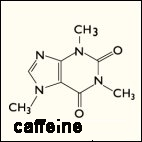 |
จากสูตรโครงสร้างทางเคมีของสารคาเฟอีน จะเห็นได้ว่า จากลักษณะโครงสร้างที่เป็นวง (cyclic) สามารถทำนายได้ว่า คาเฟอีนเป็นสารที่ไม่มีขั้ว (nonpolar) |
เนื่องจากคาเฟอีน เป็นสารที่ไม่มีขั้ว การเลือกใช้ตัวทำละลายเพื่อใช้ในการสกัดคาเฟอีน ก็จะต้องเลือกใช้ตัวทำละลายที่ไม่มีขั้วเช่นกัน ในการสกัดสารที่ไม่มีขั้ว ส่วนใหญ่แล้ว มักจะใช้เฮกเซน (hexane : C6H14) หรือ คลอโรฟอร์ม ( chloroform : CHCl3) เป็นต้น แต่สารทั้งสองตัวเป็นสารที่มีพิษต่อร่างกาย
ตัวทำละลายที่ดี เหมาะสม และประหยัดที่สุด คือ supercritical carbondioxide โดยใช้กระบวนการสกัดแบบ freez dry เพราะเราสามารถแยกคาร์บอนไดออกไซด์ออกจากคาเฟอีนได้ง่ายกว่าเฮกเซนและคลอโรฟอร์ม โดยการเปลี่ยนความดันและอุณหภูมิตามแผนผังวัฎภาค

